التهاب المهبل البكتيري من ويكيبيديا، الموسوعة الحرة
بكتيريا مهبلية
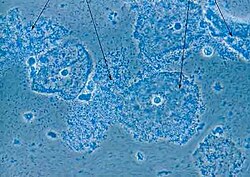
صورة مجهرية للبكتيريا المهبلية - الأنسجة الطلائيةلعنق الرحم مغطاة ببكتيريا تشبه العصيات، Gardnerella vaginalis (أسهم).
معلومات عامة
الاختصاص طب النساء
من أنواع التهاب مهبلي، وخمج جرثومي
أدوية
حمض الخليك، وكليندامايسين، ومترونيدازول
بكتيريا مهبلية

صورة مجهرية للبكتيريا المهبلية - الأنسجة الطلائيةلعنق الرحم مغطاة ببكتيريا تشبه العصيات، Gardnerella vaginalis (أسهم).
معلومات عامة
الاختصاص طب النساء
من أنواع التهاب مهبلي، وخمج جرثومي
أدوية
حمض الخليك، وكليندامايسين، ومترونيدازول
البكتيريا المهبلية (BV) هي السبب الأكثر شيوعاً للعدوى المهبلية. ولا تعتبر من الأمراض المنقولة جنسياً حيث لا تنتقل بالاتصال الجنسي؛ على الرغم من ذلك فهي أكثر شيوعاً بين النساء النشطات جنسياً.
=والسبب في الإصابة بالعدوى المهبلية هو عدم توازن الوجود البكتيري الطبيعي في المهبل،
=وينبغي عدم الخلط بين عدوى الخميرة والسفاد، أو العدوى الشائعة ببكتيريا المشعرات المهبلية (التريكوموناس) وبين العدوى بالبكتيريا المهبلية.
----------------------------
الأعراض والعلامات
الأعراض الأكثر شيوعاً هي وجود إفرازات مهبلية بيضاء متجانسة غير طبيعية (خصوصاً بعد الممارسة الجنسية) ولها رائحة كريهة. تغطى هذه الإفرازات الكريهة الرائحة جدران المهبل، وعادة ما تكون غير مهيجة أو مؤلمة أو مسببه لاحمرار الجلد.
على النقيض من ذلك، يكون دم الحيض ذو رائحة مميزة
، وتختلف لزوجته وكميته مع الدورة الشهرية. أما الإفراز الطبيعي فيكون في أوضح حالاته قبل بدء الدورة بحوالي أسبوعين.
التشخيص
لتشخيص الإصابة بالبكتيريا المهبلية، ينبغي الفحص بالمنظار وأيضاً الحصول على مسحات متتابعة من عدة ارتفاعات في المهبل. يتم فحص هذه المسحات بحثاً عن:
رائحة مميزة تشبه رائحة السمك. يُسمى هذا الاختبار اختبار النفحة، حيث تضاف كمية صغيرة من هيدروكسيد البوتاسيوم إلى شريحة مجهرية تحتوي على الإفرازات المهبلية. تصاعد رائحة مميزة تشبه رائحة السمك يُعد نتيجة إيجابية تؤكد الإصابة بالبكتيريا المهبلية.
تحول المهبل من الحامضية
عادة ما يكون المهبل حامضي إلى حد ما للسيطرة على النمو البكتيري ويتراوح الرقم الهيدروجيني من 3.8-4.2.
----------------------------
الأعراض والعلامات
الأعراض الأكثر شيوعاً هي وجود إفرازات مهبلية بيضاء متجانسة غير طبيعية (خصوصاً بعد الممارسة الجنسية) ولها رائحة كريهة. تغطى هذه الإفرازات الكريهة الرائحة جدران المهبل، وعادة ما تكون غير مهيجة أو مؤلمة أو مسببه لاحمرار الجلد.
على النقيض من ذلك، يكون دم الحيض ذو رائحة مميزة
، وتختلف لزوجته وكميته مع الدورة الشهرية. أما الإفراز الطبيعي فيكون في أوضح حالاته قبل بدء الدورة بحوالي أسبوعين.
التشخيص
لتشخيص الإصابة بالبكتيريا المهبلية، ينبغي الفحص بالمنظار وأيضاً الحصول على مسحات متتابعة من عدة ارتفاعات في المهبل. يتم فحص هذه المسحات بحثاً عن:
رائحة مميزة تشبه رائحة السمك. يُسمى هذا الاختبار اختبار النفحة، حيث تضاف كمية صغيرة من هيدروكسيد البوتاسيوم إلى شريحة مجهرية تحتوي على الإفرازات المهبلية. تصاعد رائحة مميزة تشبه رائحة السمك يُعد نتيجة إيجابية تؤكد الإصابة بالبكتيريا المهبلية.
تحول المهبل من الحامضية
عادة ما يكون المهبل حامضي إلى حد ما للسيطرة على النمو البكتيري ويتراوح الرقم الهيدروجيني من 3.8-4.2.
=تؤخذ المسحة المحملة بالإفرازات المهبليه وتوضع على ورقة عباد الشمس لفحص الحموضة فيها. ويعتبر أي رقم هيدروجيني أكبر من 4.5 قاعدى وموح بحدوث اصابه بالبكتيريا المهبلية.
وجود الخلايا الدلالية
فحص وجود الخلايا الدلالية مشابه لأختبار النفحة حيث توضع قطره من كلوريد الصوديوم على شريحة زجاجية محملة بالإفرازات المهبلية وفحص الشريحة تحت الميكرسكوب لبيان وجود الخلايا الدلالية من عدمه. سميت هذه الخلايا بالدلالية لانها دليل على وجود العدوى وأيضا تساعد في معرفه البكتيريا المسببه للعدوى ويمكن رؤيتها بالميكرسكوب الضوئى وهي خلايا من النسيج المبطن للمهبل مغطاه بالبكتيريا.
وجود الخلايا الدلالية
فحص وجود الخلايا الدلالية مشابه لأختبار النفحة حيث توضع قطره من كلوريد الصوديوم على شريحة زجاجية محملة بالإفرازات المهبلية وفحص الشريحة تحت الميكرسكوب لبيان وجود الخلايا الدلالية من عدمه. سميت هذه الخلايا بالدلالية لانها دليل على وجود العدوى وأيضا تساعد في معرفه البكتيريا المسببه للعدوى ويمكن رؤيتها بالميكرسكوب الضوئى وهي خلايا من النسيج المبطن للمهبل مغطاه بالبكتيريا.
=
نتيجتان ايجابيتان، بالإضافة إلى وجود الإفرازات نفسها يعد كافى جدا لتشخيص العدوى المهبلية. عند غياب الإفرازات، يعد وجود نتائج ايجابيه لجميع الفحوصات امر أساسي لتشخيص العدوى المهبلية. أثبتت دراسة أجريت عام 1990 أن أفضل اختبار أحادى لتشخيص العدوى المهبلية هو فحص وجود الخلايا الدلالية بأستخدام الميكروسكوب الضوئى. وأن أفضل مزيج من اختبارين لتشخيص الأصابة هو اختبار الخلايا الدلالية واختبار النفحة.
التشخيصات التفريقية للبكتيريا المهبلية:
إفرازات طبيعية.
السفاد (داء المبيضات)، أو عدوى خميريه.
داء المشعرات،
نتيجتان ايجابيتان، بالإضافة إلى وجود الإفرازات نفسها يعد كافى جدا لتشخيص العدوى المهبلية. عند غياب الإفرازات، يعد وجود نتائج ايجابيه لجميع الفحوصات امر أساسي لتشخيص العدوى المهبلية. أثبتت دراسة أجريت عام 1990 أن أفضل اختبار أحادى لتشخيص العدوى المهبلية هو فحص وجود الخلايا الدلالية بأستخدام الميكروسكوب الضوئى. وأن أفضل مزيج من اختبارين لتشخيص الأصابة هو اختبار الخلايا الدلالية واختبار النفحة.
التشخيصات التفريقية للبكتيريا المهبلية:
إفرازات طبيعية.
السفاد (داء المبيضات)، أو عدوى خميريه.
داء المشعرات،
=وهي العدوى التي تسببها المشعرة المهبلية.
الفحص السريري
في الفحص السريري تشخص العدوى البكتيرية باستخدام معايير أمسل (Amsel criteria):
الفحص السريري
في الفحص السريري تشخص العدوى البكتيرية باستخدام معايير أمسل (Amsel criteria):
=
في حالة الإصابة، تكون الإفرازات المهبلية قليلة السمك، بيضاءأو صفراء ومتجانسة.
وجود الخلايا الدلالية عند الفحص الميكروسكوبي للإفرازات.
الرقم الهيدروجيني للسائل المهبلي 4.5
تصاعد رائحة كريهة تشبه رائحة السمك عند إضافة هيدروكسيد البوتاسيوم -10 ٪ القاعدى.
لا بد أن تتواجد ثلاثة من أربعة معايير على الأقل لتأكيد التشخيص.
بديل اخر هو استخدام شريحه مثبته من الإفرازات المهبلية المصبوغة بصبغة الغرام (أجراء يستخدم لمعرفة نوع الجدار الخلوي للبكتيريا فإما أن يكون موجب الغرام أو سالب الغرام) باستخدام معايير هاي/ليسن.
تعرف معايير هاي/ليسن كالآتي:
الدرجة الأولى (العادية): تشكل بكتيريا Lactobacillus morphotypes النسبة الأكبر من الوجود البكتيري.
الدرجة الثانية(المتوسطة): وجود تعداد بكتيري من بكتيريا أخرى من اللاكتوبسيلات، وأيضا وجود أنواع بكتيريا أخرى مثل Gardnerella أو Mobiluncus morphotypes.
الدرجة الثالثة (البكتيرية المهبلية): تشكل بكتيريا Gardnerella و\أو بكتيريا morphotypes Mobiluncus التعداد الأكبر من البكتيريا. وتتميز بقلة أو غياب Lactobacilli. (هاي وآخرون، 1994)
رغم فقدان هذه التقنية للكثير نتيجة قلة موثقيتها ودقتها، إلا أنها تستعيد ما فقدته بسهولة نتيجه سهولة وسرعة الاستخدام.
المعايير البحثية هي معايير نوخنت (Nugent)، وبواسطتها تم إنشاء نطاق أفقي من 0-10 عن طريق الجمع بين ثلاث نتائج أخرى. يستغرق هذا الأسلوب وقتاً طويلاً ويتطلب أخصائيين مدربين، ولكنه عالي الدقة والموثوقية. النتائج هي كما يلي:
نتيجة سلبية (عدم وجود عدوى بكتيرية) 0-3
نتيجة متوسطة 4-6
مؤشر لوجود إصابه بالبكتيريا المهبلية 7 +.
ما لا يقل عن 10-20 عينت تم فحصها تحت عدسه بقوه 1000× مغموسة بزيت سيدر وعد الخلايا البكتريه الموجودة فيها وتحديد المتوسط.
متوسط عدد بكتيريا
Lactobacillus morphotypes بعد الفحص تحت تحت عدسه بقوه 1000× مغموسه بزيت سيدر. عرض حقول متعددة.
متوسط عدد بكتيريا
Gardnerella / وبكتيريا Bacteroides morphotypes بعد الفحص تحت تحت عدسه بقوه 1000× مغموسه بزيت سيدر. عرض حقول متعددة.
المنحنى المتغير لنتيجه أختبار الجرام (gram test)
بعد الفحص تحت تحت عدسه بقوه 1000× مغموسه بزيت سيدر. عرض حقول متعددة (لاحظ أن هذا العامل هو أقل أهمية—عشرات فقط من الممكن 0-2)
النتيجة 0 لأقل من 30
النتيجة1 للعدد من 15-30
النتيجة 2 للعدد 14
النتيجة 3 لأقل من 1 (وهذا هو في المتوسط، لذلك تكون النتائج> 0، بعد أقل من 1)
النتيجة 4 للرقم صفر
النتيجة 0 للرقم 0
النتيجة 1 لأقل من 1 (وهذا هو في المتوسط، لذلك تكون النتائج> 0، بعد أقل من 1)
النتيجة 2 للعدد1-4
النتيجة 3 للعدد5-30
النتيجة 4 للرقم> 30
النتيجة 0 للرقم 0
النتيجة 1 لأقل من 5
النتيجة 2 للأعداد +5
قارنت دراسة حديثة
أستخدام فحص صبغه الفرام وتطبيق معايير نوخنت باختبار تهجين الحمض النووي المؤكد لوجود VPIII في تشخيص العدوى المهبلية. ووجدوا أن أختبار تأكيد VPIII كشف عن Gardnerella في 107 (93.0 ٪) من 115 عينات مهبلية إيجابية التشخيص بأستخدام فحص الغرام. اختبار VPIII حساس بنسبة 87.7 ٪ ومتخصص بنسبة 96 ٪ ويمكن أن يستخدم للتشخيص السريع للعدوى المهبلية في النساء المظهرات للأعراض.
الأسبابيحتوي المهبل السليم على العديد من الكائنات الحية الدقيقة، بعض من الكائنات الشائعة هي بكتيريا Lactobacillus crispatus وبكتيريا Lactobacillus jensenii. وLactobacillus، بعض الأنواع خصوصا المفرزة لفوق أكسيد الهيدروجين تؤثر بالسلب على تكاثر أنواع الميكروبات المهبليه الأخرى إلى مستوى يمكنها من احداث أعراض. الكائنات الدقيقة المسببه للعدوى المهبليه متنوعه جدا، ولكنها تشمل بكتيريا Gardnerella vaginalis ،وبكتيريا Mobiluncus Bacteroides وبكتيريا Mycoplasma.
في حالة الإصابة، تكون الإفرازات المهبلية قليلة السمك، بيضاءأو صفراء ومتجانسة.
وجود الخلايا الدلالية عند الفحص الميكروسكوبي للإفرازات.
الرقم الهيدروجيني للسائل المهبلي 4.5
تصاعد رائحة كريهة تشبه رائحة السمك عند إضافة هيدروكسيد البوتاسيوم -10 ٪ القاعدى.
لا بد أن تتواجد ثلاثة من أربعة معايير على الأقل لتأكيد التشخيص.
بديل اخر هو استخدام شريحه مثبته من الإفرازات المهبلية المصبوغة بصبغة الغرام (أجراء يستخدم لمعرفة نوع الجدار الخلوي للبكتيريا فإما أن يكون موجب الغرام أو سالب الغرام) باستخدام معايير هاي/ليسن.
تعرف معايير هاي/ليسن كالآتي:
الدرجة الأولى (العادية): تشكل بكتيريا Lactobacillus morphotypes النسبة الأكبر من الوجود البكتيري.
الدرجة الثانية(المتوسطة): وجود تعداد بكتيري من بكتيريا أخرى من اللاكتوبسيلات، وأيضا وجود أنواع بكتيريا أخرى مثل Gardnerella أو Mobiluncus morphotypes.
الدرجة الثالثة (البكتيرية المهبلية): تشكل بكتيريا Gardnerella و\أو بكتيريا morphotypes Mobiluncus التعداد الأكبر من البكتيريا. وتتميز بقلة أو غياب Lactobacilli. (هاي وآخرون، 1994)
رغم فقدان هذه التقنية للكثير نتيجة قلة موثقيتها ودقتها، إلا أنها تستعيد ما فقدته بسهولة نتيجه سهولة وسرعة الاستخدام.
المعايير البحثية هي معايير نوخنت (Nugent)، وبواسطتها تم إنشاء نطاق أفقي من 0-10 عن طريق الجمع بين ثلاث نتائج أخرى. يستغرق هذا الأسلوب وقتاً طويلاً ويتطلب أخصائيين مدربين، ولكنه عالي الدقة والموثوقية. النتائج هي كما يلي:
نتيجة سلبية (عدم وجود عدوى بكتيرية) 0-3
نتيجة متوسطة 4-6
مؤشر لوجود إصابه بالبكتيريا المهبلية 7 +.
ما لا يقل عن 10-20 عينت تم فحصها تحت عدسه بقوه 1000× مغموسة بزيت سيدر وعد الخلايا البكتريه الموجودة فيها وتحديد المتوسط.
متوسط عدد بكتيريا
Lactobacillus morphotypes بعد الفحص تحت تحت عدسه بقوه 1000× مغموسه بزيت سيدر. عرض حقول متعددة.
متوسط عدد بكتيريا
Gardnerella / وبكتيريا Bacteroides morphotypes بعد الفحص تحت تحت عدسه بقوه 1000× مغموسه بزيت سيدر. عرض حقول متعددة.
المنحنى المتغير لنتيجه أختبار الجرام (gram test)
بعد الفحص تحت تحت عدسه بقوه 1000× مغموسه بزيت سيدر. عرض حقول متعددة (لاحظ أن هذا العامل هو أقل أهمية—عشرات فقط من الممكن 0-2)
النتيجة 0 لأقل من 30
النتيجة1 للعدد من 15-30
النتيجة 2 للعدد 14
النتيجة 3 لأقل من 1 (وهذا هو في المتوسط، لذلك تكون النتائج> 0، بعد أقل من 1)
النتيجة 4 للرقم صفر
النتيجة 0 للرقم 0
النتيجة 1 لأقل من 1 (وهذا هو في المتوسط، لذلك تكون النتائج> 0، بعد أقل من 1)
النتيجة 2 للعدد1-4
النتيجة 3 للعدد5-30
النتيجة 4 للرقم> 30
النتيجة 0 للرقم 0
النتيجة 1 لأقل من 5
النتيجة 2 للأعداد +5
قارنت دراسة حديثة
أستخدام فحص صبغه الفرام وتطبيق معايير نوخنت باختبار تهجين الحمض النووي المؤكد لوجود VPIII في تشخيص العدوى المهبلية. ووجدوا أن أختبار تأكيد VPIII كشف عن Gardnerella في 107 (93.0 ٪) من 115 عينات مهبلية إيجابية التشخيص بأستخدام فحص الغرام. اختبار VPIII حساس بنسبة 87.7 ٪ ومتخصص بنسبة 96 ٪ ويمكن أن يستخدم للتشخيص السريع للعدوى المهبلية في النساء المظهرات للأعراض.
الأسبابيحتوي المهبل السليم على العديد من الكائنات الحية الدقيقة، بعض من الكائنات الشائعة هي بكتيريا Lactobacillus crispatus وبكتيريا Lactobacillus jensenii. وLactobacillus، بعض الأنواع خصوصا المفرزة لفوق أكسيد الهيدروجين تؤثر بالسلب على تكاثر أنواع الميكروبات المهبليه الأخرى إلى مستوى يمكنها من احداث أعراض. الكائنات الدقيقة المسببه للعدوى المهبليه متنوعه جدا، ولكنها تشمل بكتيريا Gardnerella vaginalis ،وبكتيريا Mobiluncus Bacteroides وبكتيريا Mycoplasma.
=التغيير في الوجود البكتيري الطبيعي بما في ذلك خفض نسبه اللاكتوباسيلس، والذي قد يكون ناجما عن استخدام المضادات الحيوية أو عدم توازن الحامضيه، قد يسمح للبكتيريا الأكثر مقاومة بالنمو والتكاثر. هذه الميكروبات بدورها تفرز السموم التي تؤثر على دفاعات الجسم الطبيعية وتجعل إعادة استعمار البكتيريا الصحية أكثر صعوبة.وهناك مجموعة متنوعة من أسباب الإصابة بالبكتيريا المهبلية. حالات البكتيريا المهبلية أكثر عرضة للحدوث بين النساء النشطات جنسيا الذين تتراوح أعمارهم بين 15 و44، وخصوصا بعد الاتصال مع شريك جديد. الواقي الذكري قد يوفر بعض الحماية وليس هناك أي دليل على أن مبيدات الحيوانات المنويه تزيد من خطر الإصابة بالعدوى المهبلية على الرغم من أن العدوى المهبلية قد ترتبط بالاتصال الجنسي، إلا أن ليس هناك دليل واضح على أن العدوى تنتقل بالأتصال الجنسي.
=ومن الممكن للعذارى أيضا الإصابة بالبكتيريا المهبلية.
=ان العدوى المهبلية قد تكون اختلال التوازن الكيميائى والبيولوجي للكائنات الميكروبيه الموجودة في المهبل. وتستكشف الأبحاث الحديثة الصلة بين معاملة الشريك الجنسي والقضاء على الحالات المتكررة من العدوى المهبلية.و تعد النساء الحوامل والنساء المصابات بالأمراض المنتقلة جنسيا من أكثر المعرضات للإصابة بالبكتيريا المهبلية. أحياناأيضا تصاب بعض النساء بالبكتيريا المهبلية بعد انقطاع الطمث. في دراسة أجريت عام 2005 بواسطه باحثين في جامعة غينت بلجيكا أظهرت احتمالية أن تكون أعراض نقص الحديد (فقر الدم) مع عدم رصده فعليا لدى النساءالحوامل مؤشر قوي على الإصابة بالبكتيريا المهبلية.
=وفي دراسة طولية نشرت في شباط / فبراير 2006 في المجلة الأمريكية لأمراض النساء والولادة ظهر وجود علاقة بين الضغط النفسي والبكتيريا المهبلية مستقلا عن عوامل الخطر الأخرى المؤديه للأصابه.في الفتيات في سن البلوغ يكون سبب الإصابة بالبكتيريا المهبلية التعرض لبكتيريا streptococcus أو عن طريق البكتيريا المنقولة من فتحة الشرج بسبب عدم أتباع الشروط الصحية السليمة (كالمسح) بعد التحركات المعويه "عملية التبرز".
المضاعفاتعلى الرغم من أنها كانت تعتبر في السابق مجرد عدوى مزعجة، إلا أن ترك البكتيريا المهبلية دون علاج قد يسبب مضاعفات خطيرة، مثل زيادة احتمالية الإصابة بالأمراض المنقولة جنسيا بما فيها فيروس نقص المناعة البشرية، وأيضا مضاعفات أخرى للنساء الحوامل.
المُعالَجَة
المضادات الحيويةكالميترونيدازول أو الكليندامايسين هما علاج فعال لمثل تلك الإصابة سواء أخذو شفويا أو عن طريق المهبل. ومع ذلك، هناك نسبة عالية من تكرار الإصابة.
النظام الطبى المعتاد لتلقي هذا العلاج هو تناول المضاد الحيوى مترونيدازول (500 ملغم مرتين يوميا، مرة واحدة كل 12 ساعة) لمدة 7 أيام أو جرعة واحدة لمرة واحدة 2 جرام.
وعلى عكس غيره من الأمراض المعدية التي تؤثر على الأعضاء التناسلية للإناث، لا ينصح بالضرورة بعلاج الشركاء الجنسيين للمصابات كما أكدت بعض المصادر.
الطب البديلفي احدى عروض منظمة كوشران للمعلومات عن تأثيرات وسائل الرعاية الصحية عام 2009 أشير إلى ان العلاج بتناول البروبيوتيك غير مفيد في علاج البكتيريا المهبلية في حين في عرض اخر لنفس المنظمة خلصوا إلى أن البروبيوتيك فعال عندما يقترن بأستخدام المضادات الحيوية.
علم الأوبئةتشير التقديرات إلى أن واحدة من كل ثلاث نساء، تصاب بهذه العدوى البكتيرية في مرحلة ما من حياتها.
انظر أيضا
* Non-specific urethritis
التهاب المهبل بالهوائيات
المضاعفاتعلى الرغم من أنها كانت تعتبر في السابق مجرد عدوى مزعجة، إلا أن ترك البكتيريا المهبلية دون علاج قد يسبب مضاعفات خطيرة، مثل زيادة احتمالية الإصابة بالأمراض المنقولة جنسيا بما فيها فيروس نقص المناعة البشرية، وأيضا مضاعفات أخرى للنساء الحوامل.
المُعالَجَة
المضادات الحيويةكالميترونيدازول أو الكليندامايسين هما علاج فعال لمثل تلك الإصابة سواء أخذو شفويا أو عن طريق المهبل. ومع ذلك، هناك نسبة عالية من تكرار الإصابة.
النظام الطبى المعتاد لتلقي هذا العلاج هو تناول المضاد الحيوى مترونيدازول (500 ملغم مرتين يوميا، مرة واحدة كل 12 ساعة) لمدة 7 أيام أو جرعة واحدة لمرة واحدة 2 جرام.
وعلى عكس غيره من الأمراض المعدية التي تؤثر على الأعضاء التناسلية للإناث، لا ينصح بالضرورة بعلاج الشركاء الجنسيين للمصابات كما أكدت بعض المصادر.
الطب البديلفي احدى عروض منظمة كوشران للمعلومات عن تأثيرات وسائل الرعاية الصحية عام 2009 أشير إلى ان العلاج بتناول البروبيوتيك غير مفيد في علاج البكتيريا المهبلية في حين في عرض اخر لنفس المنظمة خلصوا إلى أن البروبيوتيك فعال عندما يقترن بأستخدام المضادات الحيوية.
علم الأوبئةتشير التقديرات إلى أن واحدة من كل ثلاث نساء، تصاب بهذه العدوى البكتيرية في مرحلة ما من حياتها.
انظر أيضا
* Non-specific urethritis
التهاب المهبل بالهوائيات
----------







